
Несмотря на широкое применение проточной цитофлюориметрии в различных областях современной медицины, на российском рынке представлены в основном зарубежные крупные фирмы-производители. Цель: сравнить набор реагентов для проточной цитометрии Российской фирмы-производителя с зарубежными моноклональными антителами на проточных цитофлюориметрах разных производителей.
Том 15, №2. С. 101-196
2013
Официальный журнал Санкт-Петербургского Регионального Отделения Российской Ассоциации Аллергологов и Клинических Иммунологов
Данный выпуск реализован при финансовой поддержке Правительства Санкт-Петербурга
Медицинская иммунология 2013, Т. 15, М2, стр. 177-184 ©2013, СПб РОРААКИ
Medical'Immunology 2013, Vol. 15, No2,pp. 177-184 ©2013, SPbRAACI
Попова А.А.1, Серебровская Л.В.1, Иванова Л.А.1, Хохлова О.Н.1, Новожилов С.Н.2
' ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Москва, Россия
2 Evrogen JSC, Москва, Россия
Резюме. Несмотря на широкое применение проточной цитофлюориметрии в различных областях современной медицины, на российском рынке представлены в основном зарубежные крупные фирмы-производители. Цель: сравнить набор реагентов для проточной цитометрии Российской фирмы-производителя с зарубежными моноклональными антителами на проточных цитофлюориметрах разных производителей. Материалом для исследования являлась венозная кровь. Исследуемые показатели измерялись методом проточной цитофлюориметрии. Для иммунофенотипирования применялись моноклональные антитела Becton Dickinson (USA), Лаборатория Константа (Россия) и Beckman Coulter (USA). Анализ Блэнда—Альтмана показал практически полное отсутствие систематического расхождения и относительно небольшой разброс полученных значений. Критерий Фридмана выявил, что значения измеряемых параметров различными моноклональными антителами не отличаются по уровню значимости 0,01. В результате проведенных исследований мы получили данные, что, во-первых, реагенты «Клим-Тест» в сравнении с реагентами зарубежных фирм имеют практически полное отсутствие систематического расхождения и относительно небольшой разброс значений. Реагенты «Клим-Тест» могут быть использованы на проточных цитометрах компаний Becton Dickinson (USA) и Beckman Coulter (USA). Во-вторых, реагент одинаково работает при уровне С04-лимфоцитов выше и ниже 500 клеток/мкл. В-третьих, применение реагентов «Клим-Тест» с трехцветной меткой по CD45 (CD3-FITC/CD4-PE/CD45-PE-Cy5) соответствует стандартам подсчета С04-лимфоцитов у ВИЧ-инфицированных пациентов, что позволяет рекомендовать данный реагент для мониторинга ВИЧ-инфекции.
Ключевые слова: моноклональные антитела, гейтирование по CD45, двухплатформенная методика
Адрес для переписки: Попова Анна Анатольевна к.м.н., научный сотрудник ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора 111123, Россия, Москва, ул. Новогиреевская, За. E-mail: asya-med@mail.ru Поступила 09.07.2012 Отправлена на доработку 04.08.2012 Принята к печати 23.10.2012 | Авторы: Попова А.А. — к.м.н., научный сотрудник ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Москва Серебровская Л.В. — к.м.н., старший научный сотрудник ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Москва Иванова Л.А. — научный сотрудник ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Москва Хохлова О.Н. — младший научный сотрудник ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, Москва Новожилов С.Н. — сотрудник Evrogen JSC, Москва Медицинская иммунология 2013, Т. 15, №2, стр. 177-184 © 2013, СПб РО РААКИ |
Современная диагностика гематологических заболеваний не ограничивается только клиническим анализом форменных элементов крови. Проточная цитофлюориметрия с помощью моноклональных антител дала возможность типировать клетки не только благодаря их морфологическим различиям, но и за счет набора поверхностных антигенов и рецепторов, характерных для строго определенных клеток и их функционального состояния [1]. Поэтому не удивительно, что метод проточной цитометрии прочно вошел в лабораторную практику многих центров.
Например, при ВИЧ-инфекции, где важное значение имеет определение абсолютного и относительного количества С D 4 - л им ф о ц и то в [2], все чаще используют возможности проточной цитометрии. Sharcer и соавт. предлагают использовать процент «наивных» С04-лимфоцитов в качестве нового маркера для определения более раннего момента показаний к началу АРВТ [11]. Изменение фенотипа CD8-лимфоцитов (экспрессия CD38) имеет большую значимость для оценки прогрессирования ВИЧ-инфекции [6, 9, 10].
Помимо этого методом проточной цитометрии можно получать самые разные данные: определять содержание в клетке ДНК и РНК, суммарное количество белков и количество специфических белков, узнаваемых моноклональными антителами, исследовать клеточный метаболизм (например, измерять внутриклеточный pH), изучать транспорт ионов кальция и кинетику ферментативных реакций [8].
Несмотря на широкое применение проточной цитофлюориметрии в различных областях современной медицины, на российском рынке представлены в основном зарубежные крупные фирмы-производители.
Данная проблема усугубляется практически недостаточной информацией о российских производителях моноклональных антител для нужд проточной цитофлюориметрии.
Цель исследования: сравнить набор реагентов для проточной цитометрии «КЛИМ-Тест» (ООО «Лаборатория Константа», Россия) с зарубежными моноклональными антителами (Becton Dickinson, USA и Beckman Coulter, USA) на проточных цитофлюориметрах разных производителей (Becton Dickinson, USA и Beckman Coulter, USA).
Материалом для исследования являлась венозная кровь. Забор крови для иммунофеноти- пирования и общего анализа крови проводился у пациентов утром натощак, в вакуумную пробирку VACUTANER, содержащую антикоагулянт К3ЭДТА. Сразу же после забора кровь аккуратно перемешивали с антикоагулянтом во избежание образования сгустков.
Для определения основных гематологических показателей (общего количества эритроцитов, лейкоцитов, тромбоцитов, гемоглобина, лейкоцитарной формулы крови) образцы исследовались на гематологическом анализаторе ACT diff, Beckman Coulter.
Для иммунофенотипирования применялись моноклональные антитела (МаТ) Becton Dickinson (USA), Лаборатория Константа (Россия) и Beckman Coulter (USA). Пробоподготовка к иммунофенотипированию осуществлялась согласно инструкции МаТ по безотмывочной технологии в два этапа (внесение МаТ, внесение лизирующего раствора). Использовали следующие комбинации МаТ:
Лизирующий раствор выбирали в соответствии с фирмой-производителем моноклональных антител (Лаборатория Константа — Реагент для лидирования эритроцитов, Beckman Coulter — Optilyse С-однокомпонентный лизирующий раствор, Becton Dickinson — Lysing Solution).
Нами были проанализированы результаты измерений относительного и абсолютного содержания субпопуляций лимфоцитов в двух группах образцов. В 1 группе был 21 образец крови, во 2-ой группе — 15. Опытные образцы были взяты у пациентов, наблюдавшихся в ФНМЦ ПБ СПИД по поводу ВИЧ-инфекции или других инфекционных заболеваний.
Опытные образцы 1 группы использовали для определения абсолютного и относительного количества CD4- и СD3-лимфоцитов на двух приборах разных фирм-производителей. На проточном цитофлюориметре FACSCalibur (BD, USA), используя программное обеспечение CellQuest, были проанализированы пробы приготовленные с помощью МаТ «КЛИМ-Тест» (Лаборатория Константа, Россия) и MultiTEST (Becton Dickinson, USA). При анализе на Epics (Coulter, USA) были использованы пробы, приготовленные с помощью МаТ «КЛИМ-Тест» (Лаборатория Константа, Россия) и IOTest (Beckman Coulter, USA).
Опытные образцы 2-ой группы использовали для определения абсолютного и относительного количества CD8- и CD 19-лимфоцитов также на двух проточных цитометрах разных фирм- производителей. При анализе на FACSCalibur (Becton Dickinson, USA) в программе CellQuest были использованы пробы, приготовленные с помощью МаТ «КЛИМ-Тест» (Лаборатория Константа, Россия) и MultiTEST (Becton Dickinson, USA). При анализе на Epics (Beckman Coulter, USA) были использованы пробы, приготовленные с помощью реагентов «КЛИМ-Тест» (Лаборатория Константа, Россия).
Для определения относительного содержания субпопуляций лимфоцитов использовали анализ с гейтированием по CD45. На рисунке 1 представлен алгоритм анализа образца на проточных цитометрах FACSCalibur (BD, USA) и Epics (Beckman Coulter, USA) с использованием МаТ CD3-FITC/ CD4-PE/CD45-PE-Cy5 («КЛИМ-Тест», Лаборатория Константа, Россия) с целью определения относительного содержания С04-лимфоцитов. Для идентификации лейкоцитов и лимфоцитов используется CD45 в сочетании с боковым светорассеянием (SS) (рис. 1А, В). Гейт R1 нарисован вокруг СD45-положительных клеток с низким боковым светорассеянием (лимфоциты) [7, 12]. Распределяя клетки из гейта R1 по наличию рецепторов CD4 (рис. 1Б, Г), мы получаем процентное содержание С04-лимфоцитов. Подсчет абсолютного содержания С04-лимфопитов, как и остальных субпопуляций лимфоцитов, осуществлялся двухплатформенным методом: путем математического пересчета количества лейкоцитов и лимфоцитов в образце периферической крови и полученного процентного содержание С04-лимфоцитов [3].
Для обработки статистических данных использовалась программа GraphPad Prism5. Рассчитывали следующие показатели: среднее, медиана, минимальное и максимальное значение, стандартное отклонение, критерий Блэнда- Альтмана, критерий Фридмана [4].
В таблицах 1 и 2 представлены данные описательной статистики результатов измерения относительных и абсолютных значений субпопуляций лимфоцитов, выполненных различными реагентами на различных приборах.
Особого внимания заслуживает тот факт, что в группу определения относительных и абсолютных значений С D4 - лимфоцитов вошли пробы как с высоким, так и с низким содержанием данного показателя (табл. 1).
По данным описательной статистики мы не видим сильных отличий в результатах, полученных при использовании различных методик. Для более информативного представления применим анализ Блэнда—Альтмана (табл. 3, 4). На графиках Блэнда—Альтмана отображалась разность значений количества С04-лимфоцитов, полученных двумя сравниваемыми методами (по оси у), относительно среднего этих значений (по оси х) (рис. 2). Подсчитывалась средняя разница значений (bias), которая характеризует систематическое расхождение результатов, и границы согласия (Limits of Agreement; LOA),
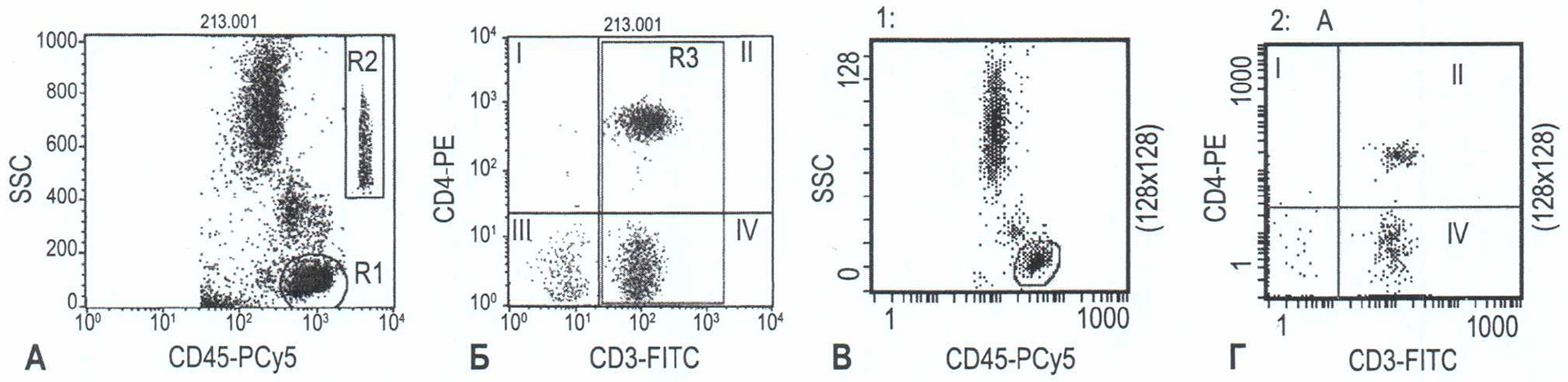
Рисунок 1. Алгоритм определения CD4- и СDЗ-лимфоцитов с использованием МаТ CD3-FITC/CD4-PE/CD45-PE-Cy5 («КЛИМ-Тест», Лаборатория Константа, Россия)
Примечание. А, Б - алгоритм анализа на проточном цитометре FACSCalibur (BD, USA) и Epics (Beckman Coulter, USA): A - гистограмма распределения лейкоцитов периферической крови с использованием CD45 меченного РСу5. Б - CD3*CD4* Т-клетки (квадрант II), R3- CDЗ-лимфоциты. В, Г - алгоритм анализа на проточном цитометре Epics (Beckman Coulter, USA): В - гистограмма распределения лейкоцитов периферической крови с использованием CD45 меченного РСу5. Г - СD3*СD4+Т-клетки (квадрант II), СDЗ-лимфоциты - квадрант II+IV.
ТАБЛИЦА 1. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЯ ОТНОСИТЕЛЬНЫХ И АБСОЛЮТНЫХ ЗНАЧЕНИЙ CD4- И CDЗ-ЛИМФОЦИТОВ [n = 21; M±SD; Me (min-max)] | |||
Методика (прибор + реагент) | |||
Calibur / КЛИМ-Тест | Calibur /MultiTEST | Epics / КЛИМ-Тест | Epix / lOTest |
CD4-лимфоциты, % | |||
32,13+11,06 | 32,29±10,54 | 32,48±11,19 | 31,86±10,55 |
27,7 (15,7-54,0) | 30,0 (15,0-52,0) | 28,30 (15,3-53,3) | 28,0 (16,0-51,0) |
CD4-лимфоциты, клеток/мкл | |||
650,0±330,19 | 659,2±318,96 | 664,19+334,04 | 651,24±313,4 |
574,0 (270,0-1782,0) | 602 (258-1716) | 604,0 (263,0-1759,0) | 598 (275-1683) |
СDЗ-лимфоциты, % | |||
77,65±6,78 | 77,81±6,72 | 77,89±6,57 | 77,6±6,58 |
78,30 (61,7-87,3) | 77,0 (62,0-88,0) | 77,6 (63,3-87,30) | 77,2 (62,0-88,0) |
CDЗ-лимфоциты, клеток/мкл | |||
1552,86±349,1 | 1555,3+346,5 | 1558,14±351,9 | 1551,8±348,9 |
1516,0 (1064,0-2363,0) | 1492,0 (1068,0-2391,0) | 1505,0 (1055,0-2400,0) | 1488,0 (1094,0-2391,0) |
ТАБЛИЦА 2. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЯ ОТНОСИТЕЛЬНЫХ И АБСОЛЮТНЫХ ЗНАЧЕНИЙ CD8- И С019-ЛИМФ0ЦИТ0В [п = 15; M±SD; Me (min-max)] | ||
Методика (прибор + реагент) | ||
Calibur / КЛИМ-Тест | Calibur / MultiTEST | Epics / КЛИМ-Тест |
CD8-лимфоциты, % | ||
26,43±7,66 | 26,9318,16 | 26,2018,16 |
29,0 | 29,0 | 29,0 |
(12,0-40,0) | (13,0-42,0) | (12,0- 39,0) |
CD8-лимфоциты, клеток/мкл | ||
550,071177,96 | 561,31188,27 | 543,331183,6 |
528,0 | 528,0 | 505,0 |
(159,0-846,0) | (172,0-893,0) | (159,0-810,0) |
CD19-лимфоциты, % | ||
10,6514,05 | 10,6014,15 | 10,7313,94 |
10,0 | 10,0 | 10,0 |
(5,0-20,0) | (5,0-19,0) | (6,0-19,0) |
CD19-лимфоциты, клеток/мкл | ||
243,201169,92 | 236,731156,66 | 233,81155,03 |
187,0 | 184,0 | 184,0 |
(93,0-739,0) | (93,0-669,0) | (94,0-669,0) |
ТАБЛИЦА 3. РЕЗУЛЬТАТЫ АНАЛИЗА ПО МЕТОДУ БЛЭНДА-АЛЬТМАНА ДЛЯ ОТНОСИТЕЛЬНЫХ И АБСОЛЮТНЫХ ЗНАЧЕНИЙ CD4- И СDЗ-ЛИМФОЦИТОВ (n = 21) | ||||
Исследуемые параметры | Прибор + Реагент | |||
Calibur | Epics | Calibur / Epics | ||
КЛИМ-Тест/ MultiTEST | КЛИМ-Тест / lOTest | КЛИМ-Тест /КЛИМ- Тест | ||
CD4, % | Bias | -0,1524 | 0,6238 | -0,3476 |
SD of bias | 1,375 | 1,192 | 0,9421 | |
95% Limits of Agreement | -2,847; 2,543 | -1,712; 2,959 | -2,194; 1,499 | |
CD4, клеток/мкл | Bias | -9,238 | 12,95 | -14,19 |
SD of bias | 38,29 | 32,45 | 39,41 | |
95% Limits of Agreement | -84,49; 66,02 | -50,65; 76,56 | -91,43; 63,05 | |
CD3, % | Bias | -0,1571 | -0,2857 | -0,2333 |
SD of bias | 1,357 | 1,393 | 0,9911 | |
95% Limits of Agreement | -2,817; 2,503 | -2,444; 3,016 | -2,176; 1,709 | |
CD3, клеток/мкл | Bias | -2,429 | 6,476 | -5,238 |
SD of bias | 28,22 | 25,86 | 20,22 | |
95% Limits of Agreement | -57,74; 52,89 | -44,20; 57,16 | -44,88; 34,40 | |
| ТАБЛИЦА 4. РЕЗУЛЬТАТЫ АНАЛИЗА ПО МЕТОДУ БЛЭНДА-АЛЬТМАНА ДЛЯ ОТНОСИТЕЛЬНЫХ И АБСОЛЮТНЫХ ЗНАЧЕНИЙ CD8- И CD19-ЛИМФОЦИТОВ (n = 15) | |||
Исследуемые параметры | Реагент + Прибор | ||
Calibur | Calibur / Epics | ||
КЛИМ-Тест/MultiTEST | КЛИМ-Тест / КЛИМ-Тест | ||
CD8, % | Bias | 0,5 | 0,2333 |
SD of bias | 1,524 | 1,208 | |
95% Limits of Agreement | -3,486; 2,486 | -2,135; 2,601 | |
CD8, клеток/мкл | Bias | -11,27 | 6,733 |
SD of bias | 43,15 | 29,22 | |
95% Limits of Agreement | -95,85; 73,32 | -50,55; 64,01 | |
CD19, % | Bias | -0,233 | 0,367 |
SD of bias | 0,678 | 0,812 | |
95% Limits of Agreement | -1,095; 1,562 | -1,225; 1,958 | |
CD19, клеток/мкл | Bias | 6,467 | 9,4 |
SD of bias | 19,75 | 21,48 | |
95% Limits of Agreement | -32,25; 45,18 | -32,69; 51,49 | |
ТАБЛИЦА 5. Р-ЗНАЧЕНИЕ КРИТЕРИЯ ФРИДМАНА ДЛЯ ОТНОСИТЕЛЬНЫХ И АБСОЛЮТНЫХ ЗНАЧЕНИЙ CD4-, CD8-, CD3- И CD19-ЛИМФ0ЦИТ0В | |
Исследуемый показатель | P-значение критерия Фридмана |
CD4-лимфоциты, % (п = 21) | 0,313 |
CD4-лимфоциты, клеток/мкл (п = 21) | 0,342 |
CD8-лимфоциты, % (п = 15) | 0,122 |
CD8-лимфоциты, клеток/мкл (п = 15) | 0,195 |
CDЗ-лимфоциты, % (п = 21) | 0,532 |
CDЗ-лимфоциты, клеток/мкл (п = 21) | 0,499 |
CD19-лимфоциты, % (п = 15) | 0,156 |
CD19-лимфоциты, клеток/мкл (п = 15) | 0,156 |
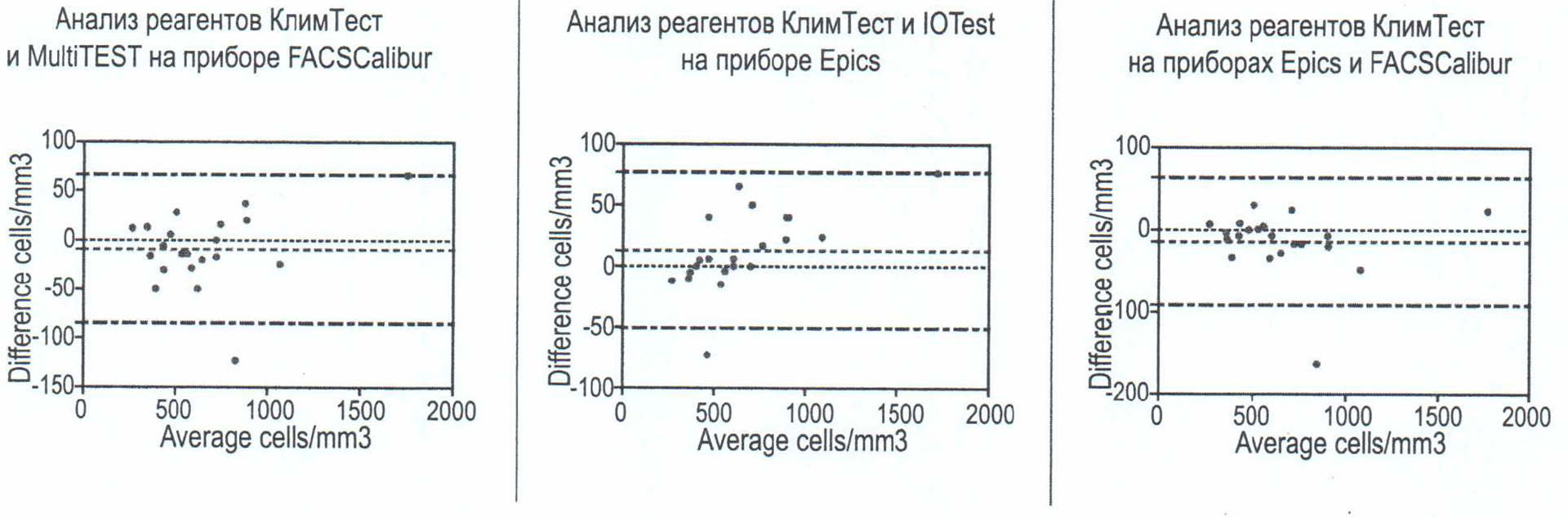 Рисунок 2. Анализ Блэнда-Альтмана для абсолютных значений CD-4-лимфоцитов
Рисунок 2. Анализ Блэнда-Альтмана для абсолютных значений CD-4-лимфоцитов
Ссылки 6-12 см. в References (стр. 184). See References for numbers 6-12 at p. 184.
Реагенты КЛИМ-Тест предназначены для проведения исследований методом проточной цитометрии, позволяют быстро и качественно, с оптимизацией финансовых затрат лаборатории, получать результаты по оценке базовых параметров Клеточного Иммунитета
Качество
Скорость
30 минут - время проведения пробоподготовки образцов при использовании 3-х цветных реагентов КЛИМ-Тест:
Процедура отмывания не требуется.
Оптимизация финансовых расходов
Демократичные цены на реагенты КЛИМ-Тест позволяют перераспределять средства для расширения спектра исследований, проводимых в лаборатории
Для любых лабораторий проточной цитометрии
Возможность использования реагентов на открытых системах проточных цитофлуориметров в лазером 488 нм различных производителей
3-цветные моноканальные антитела, 50 тестов*:
- CD3 FITC/ CD4 PE/ CD45 PE-Cy5
- CD3 FITC/ CD8 PE/ CD45 PE-Cy5
- CD3 FITC/ CD19 PE/ CD45 PE-Cy5
- CD3 FITC/ CD19+56 PE/ CD45 PE-Cy5
2-цветные моноканальные антитела, 50 тестов
Дополнительные реагенты
* Пик эмиссии используемых флюорохромов: FITC- нм, PE- 575 нм, PE-Cy5- нм
Комментарии
Пока никто не оставлял здесь записей.